505(b)(1)
LXP108
LXP108 is a new chemical entity, and in our plan, it will treat carcinoma related to the digestive system.
适应症
实体肿瘤
- 肾脏肿瘤
- 肝癌
- 胰脏癌
Science
多靶点激酶抑制剂(Multi-target Kinase Inhibitor)
LXP108 is a multi-target kinase inhibitor that simultaneously inhibits multiple signaling pathways essential for cancer cell proliferation.
优势::
- 更有效的抑制癌细胞生长
- 降低副作用
- 克服抗药性
临床上也证明多靶点药物比单一靶点药物可以更有效的抑制癌肿瘤细胞的生长,展现更好更广的抗癌效果
最新进展
- 于2024年进入第一阶段临床试验
- 美国FDA及台湾TFDA IND申请中
临床前
申请
第一阶段
第二阶段
第三阶段
上市
Phase1
Pre-clinical 临床前研究
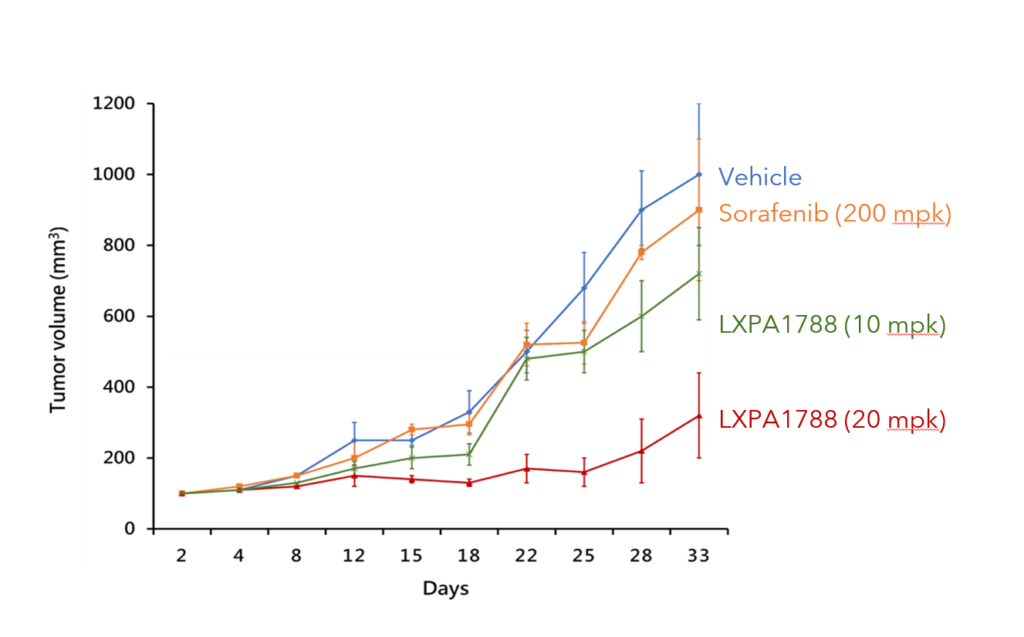
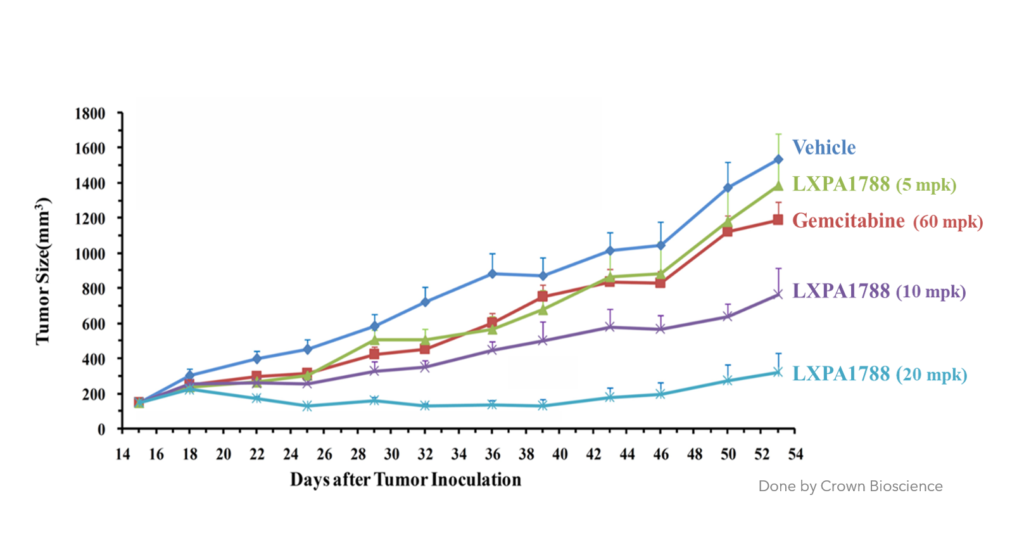
LXP108 can effectively inhibit 胰脏癌及肝癌 (动物试验)
胰脏癌
肝癌
比较药物相关说明
Linifanib
- 抑制受体酪胺酸激酶(RTK)、血管内皮生长因子(VEGF)和血小板衍生生长因子(PDGF)
- 目前处于第三期临床试验。
- 适应症
肝细胞癌
Sorafenib
- 抑制Raf激酶、PDGF(血小板衍生生长因子)、VEGF受体2和3激酶,以及c-Kit(干细胞因子受体)
- 于2005年12月20日首次获得FDA批准。
- 适应症
2005年:晚期肾细胞癌
2007年:无法切除的肝细胞癌
2013年:转移性分化型甲状腺癌(Metastatic Differentiated Thyroid Cancer)
Midostaurin
- 抑制蛋白激酶Cα、VEGFR2、KIT、PDGFR以及野生型/突变型FLT3酪胺酸激酶。
- 于2017年4月28日获得FDA批准。
- 适应症
2017年:FLT3突变型急性骨髓性白血病(AML)及系统性肥大细胞增多症(Systemic Mastocytosis)
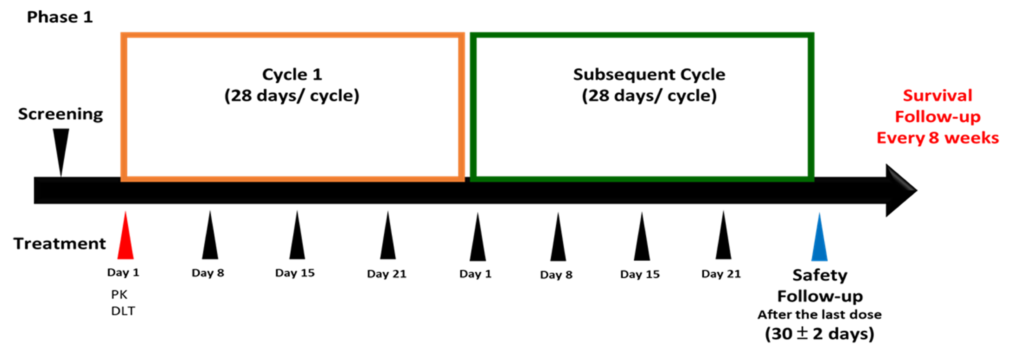
Clinical Study Design 临床试验之规划
Phase I 临床试验预计于 2024 Q2进行
执行医院
三家台湾医院
收案对象
实体肿瘤病患
预计收案人数
预计收30~40名临床受试者
研究方法
Adaptive 3+3
治疗时程
预计一次疗程为六个月
药物治疗频率
预计一周注射药物一次
专利
取得美国、台湾地区、南韩、中国、欧洲,总计17个地区。
- United States
- Taiwan
- Korea
- China
- Europe
