505(b)(1)
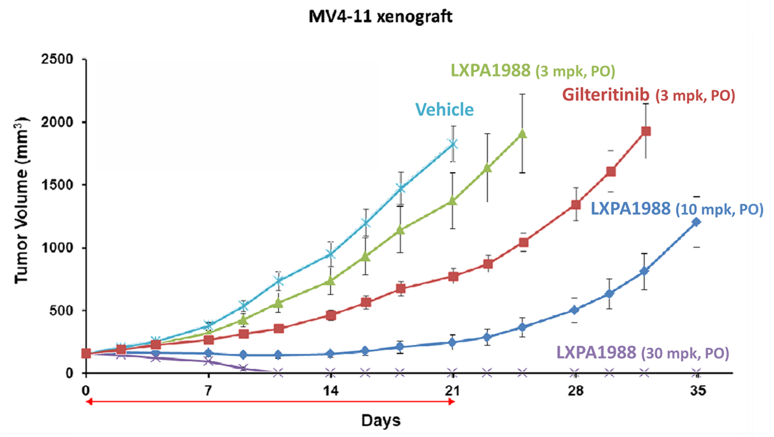
LXP107
This product is a new chemical entity (NCE), specifically a kinase inhibitor targeting FLT3. Animal studies show that LXP107 also effectively inhibits mutated FLT3. Currently, preclinical studies and new formulation designs are underway.
適應症
FLT3 突變急性骨髓性白血病 (AML)
流行病學
- 全球AML每年新增人數:約19萬人
- 全球攜帶 FLT3 突變的 AML 患者人數約為 65,000 名(30-35%)。
- 它被分類為 orphan disease (孤兒病) (<20萬人)
開發優勢
- 加速審核上市(2020 年 12 月獲得 EMA 授權 aspacytarabine)。
- 臨床費用稅務減免(美國 - 25% 折扣)。
- 核准後享有市場獨佔期七年(美國)/十年(台灣)。
- 截至2016年,孤兒藥的年費用中位數超過$32,000美金。
最新進展
臨床前(Preclinical)
申請(IND)
第一階段(Phase 1)
第二階段(Phase 2)
第三階段(Phase 3)
市場(Market)
臨床前(Preclinical)