505(b)(1)
LXPA1988
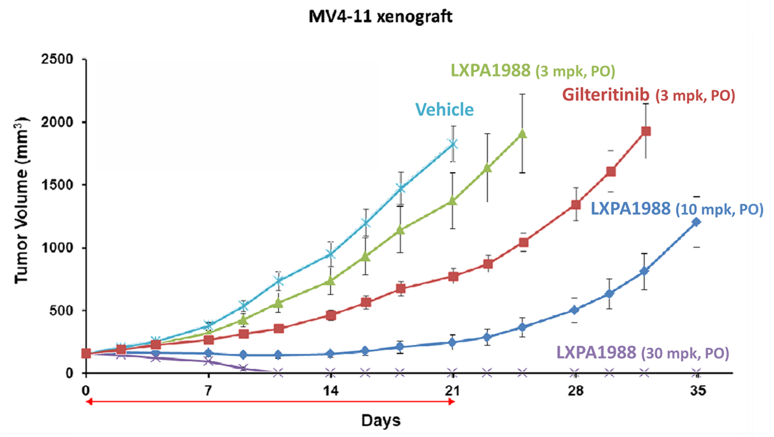
本产品为新成分新药,是一对 FLT3 具有专一性的激酶抑制剂,目前已取得美国与台湾之结构专利;动物试验结果显示,LXP1988 对于突变的 FLT3 也同样具有抑制效果。目前正进行临床前相关研究及新剂型设计。
适应症
FLT3 突变急性骨髓性白血病(AML)
流行病学
- 全球AML每年新增人数:约19万人
- 全球携带FLT3 突变的AML 患者人数约为65,000 名(30-35%)。
- 它被分类为 orphan disease (孤儿病) (<20万人)
开发优势
- 加速审核上市(2020 年12 月获得EMA 授权aspacytarabine)。
- 临床费用税务减免(美国- 25% 折扣)。
- 核准后享有市场独占期七年(美国)/十年(台湾)。
- 截至2016年,孤儿药的年费用中位数超过$32,000美金。
最新进展
临床前
申请
第一阶段
第二阶段
第三阶段
上市
临床前